
Em que consiste a notificação espontânea?
Relato voluntário e simplificado de uma ocorrência (evento adverso), associada a um tratamento suspeito (medicamento) utilizado por um individuo (doente – mesmo que saudável inicialmente, adoeceu com a RAM) e notificado pelo mesmo ou por outra pessoa (notificador).
A notificação pode ser realizada diretamente para o INFARMED, I.P. (DGRM) ou para as Unidades de Farmacovigilância (UF) através de telefone, fax, correio ou via eletrónica (email), podendo recorrer aos impressos Ficha de Notificação para Profissional de Saúde / Ficha de Notificação para Utente, sites das UF ou online pelo PortalRAM.
As Fichas de Notificação constituem impressos normalizados e aprovados pela autoridade competente, INFARMED I.P., para o efeito de notificar suspeitas de reação adversa pelos profissionais de saúde ou por utentes e encontram-se disponíveis no site do INFARMED, I.P. ou em papel, quando solicitadas para o INFARMED, I.P..
A Ficha de Notificação, após preenchida, pode ser endereçada, por correio, fax ou eletronicamente (após digitalização) para a UFS ou para a DGRM.
Contactos UFS:
Morada: Avenida Prof. Gama Pinto S/N 1649-003 Lisboa
Telefone/Fax: 217 971 340
Email: ufs@ff.ulisboa.pt
Contactos DGRM:
Morada: Parque de Saúde de Lisboa – Avenida do Brasil, 53
1749-004 Lisboa – Portugal
Telefone: +351 217 987 140; +351 217 987 141
Fax: +351 217 987 397
Email: farmacovigilancia@infarmed.pt
Para obter os impressos das fichas click nos links infra
Para os utilizadores das ferramentas eletrónicas a notificação pelo site da UFS é um procedimento muito acessível e rápido.
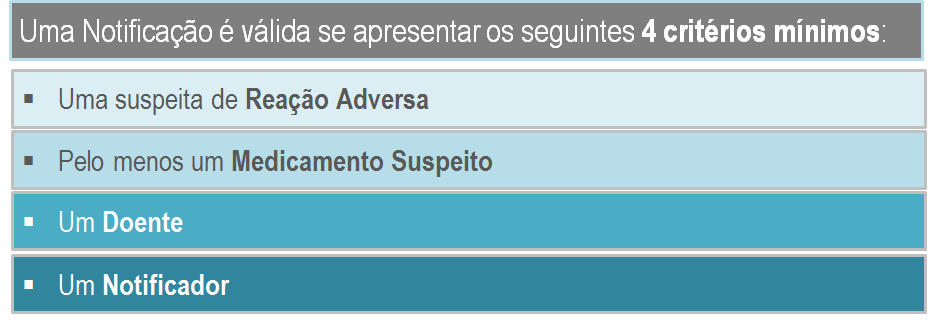
A submissão da notificação (suspeita de reação adversa a medicamento) não consome mais do que 5 minutos e requere no mínimo o preenchimento dos seguintes 4 critérios:
Após a submissão da notificação, o Notificador recebe email com os dados inseridos.
O PortalRAM é uma plataforma de notificação online criada originalmente em 2012 e totalmente renovada em Novembro 2017, pela autoridade reguladora, INFARMED, I.P., e que permite aos profissionais de saúde e utentes submeter as suas suspeitas de reações adversas, através da via eletrónica.
O notificador após a submissão da notificação recebe através de email as seguintes comunicações:
Para reportar um problema de qualidade associado a um medicamento sem reação adversa deve fazê-lo para a Direção de Inspeção e Licenciamento (DIL) do INFARMED, I.P. através do impresso próprio – NotificacaoDefeitosQualidade

O registo e monitorização dos dispositivos médicos é da responsabilidade do INFARMED I.P., através da Unidade de Vigilância de Produtos de Saúde.
O reporte de eventos adversos associados à utilização de dispositivos médicos, designados por incidentes, deve ser realizado através dos instrumentos próprios criados para o efeito – Instrumentos para Notificação de Incidentes.
Contactos
Unidade de Vigilância de Produtos de Saúde
Infarmed
Parque de Saúde de Lisboa, Av. do Brasil, 53, Pav. 17A
1749-004 Lisboa PORTUGAL
Tel: +351 21 798 7145
Fax: +351 21 111 7559
E-mail: dvps@infarmed.pt
Os suplementos alimentares não são da competência do INFARMED, I.P. pelo que a notificação de efeitos indesejáveis a este tipo de produtos deve ser enviada para a Direção de Serviços de Nutrição e Alimentação (DSNA) da Direção-Geral de Alimentação e Veterinária (DGAV).
A notificação de efeitos indesejáveis a suplementos alimentares pode ser realizada no site da DGAV segundo o Procedimento de notificação de acordo com Decreto-Lei n.º 118/2015.
Contactos
DGAV – Direção-Geral de Alimentação e Veterinária
Direção de Serviços de Nutrição e Alimentação
Largo da Academia Nacional de Belas Artes, n.º 2
1249-105 Lisboa
Tel: +351 213 613 271
Fax: +351 213 613 277
E-mail: dsna@dgav.pt
Nota Informativa
Documento Orientador quanto aos aspetos a considerar no enquadramento de um produto como medicamento ou como suplemento alimentar
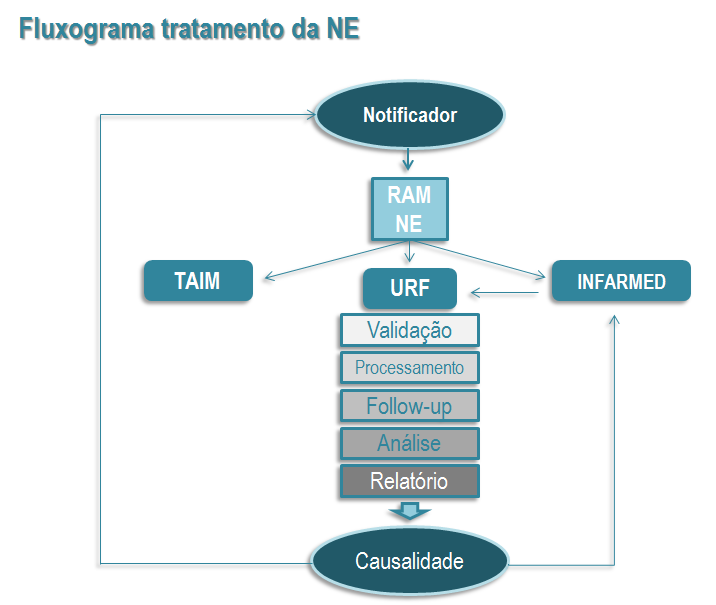
O notificador pode submeter a sua suspeita de reação adversa (RAM) para o Titular de Autorização de Introdução no Mercado (TAIM) do medicamento suspeito, diretamente ao INFARMED I.P. ou à Unidade Farmacovigilância (UF) da sua área de atividade ou residência.
A totalidade dos casos notificados a nível nacional fica arquivada na base nacional SVIG, sob a responsabilidade da DGRM (INFARMED I.P.) qualquer que seja a sua origem. Posteriormente esta informação é partilhada com a Agência Europeia do Medicamento (EMA) e com a Organização Mundial de Saúde (OMS), permitindo a sua análise em contextos mais alargados.
O tratamento da notificação pressupõe as seguintes etapas:
Procedimentos de Farmacovigilância para Farmácia Comunitária (em execução)
Procedimentos de Farmacovigilância para Farmácia Hospitalar (em execução)