A Unidade de Farmacovigilância Setúbal e Santarém (UFS) constitui parte integrante do Sistema Nacional de Farmacovigilância (SNF).
Sistema Nacional de Farmacovigilância (SNF)
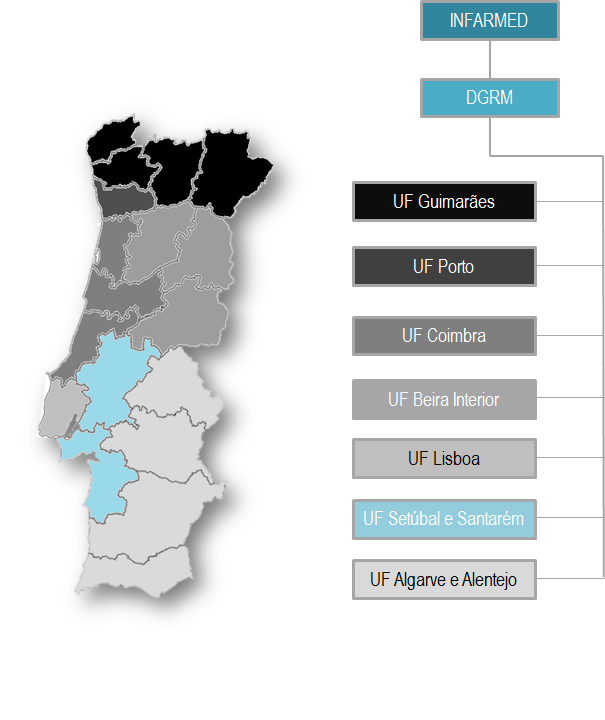
O Sistema Nacional de Farmacovigilância (SNF) assenta essencialmente na metodologia da notificação espontânea e encontra-se centrado na Direção de Gestão do Risco do Medicamento (DGRM) do INFARMED, I.P..
O SNF possui atualmente 8 Unidades de Farmacovigilância (UF), sendo que a DGRM assume a responsabilidade de uma destas organizações, reportam todas elas a esta mesma Direção do Infarmed e, desta forma, cobrem a totalidade do território continental e regiões autónomas de Portugal.
- Distritos de Viana do Castelo, Braga, Bragança e Vila real – Unidade de Farmacovigilância de Guimarães (UF Guimarães)
- Distrito do Porto – Unidade de Farmacovigilância do Porto (UF Porto)
- Distritos de Aveiro, Coimbra e Leiria – Unidade de Farmacovigilância de Coimbra (UF Coimbra)
- Distritos da Guarda, Castelo Branco e Viseu – Unidade de Farmacovigilância da Beira Interior (UF Beira Interior)
- Distrito de Lisboa – Unidade de Farmacovigilância de Lisboa (UF Lisboa)
- Distritos de Setúbal e Santarém – Unidade de Farmacovigilância Setúbal e Santarém (UF Setúbal e Santarém)
- Distritos de Faro, Beja, Évora e Portalegre – Unidade de Farmacovigilância do Algarve e Alentejo (UF Algarve e Alentejo)
- Regiões autónomas dos Açores e da Madeira e alguns concelhos de Lisboa e Leiria – DGRM
 |
Unidade de Farmacovigilância Setúbal e Santarém (UFS)
A Unidade de Farmacovigilância de Setúbal e Santarém (UFS), foi criada em Janeiro de 2017 através de um contrato de prestação de serviços de Farmacovigilância celebrado entre o INFARMED, I.P. e a Faculdade de Farmácia da Universidade de Lisboa, e localiza-se nesta última instituição, sita na Avenida Professor Gama Pinto S/N, 1649-003, Lisboa.
É pessoa coletiva de direito público, dotada de autonomia técnica e administrativa e financiada através de um contrato de prestação de serviços com o INFARMED, I.P..
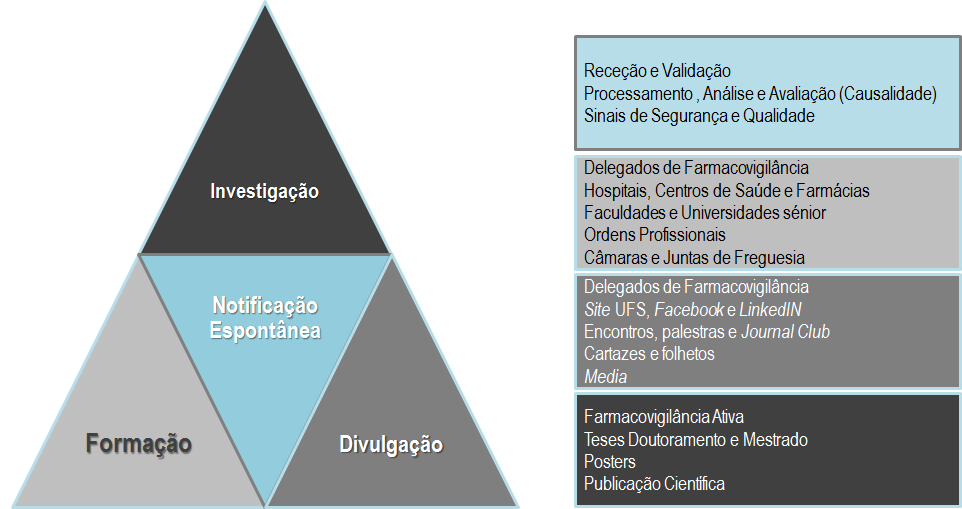
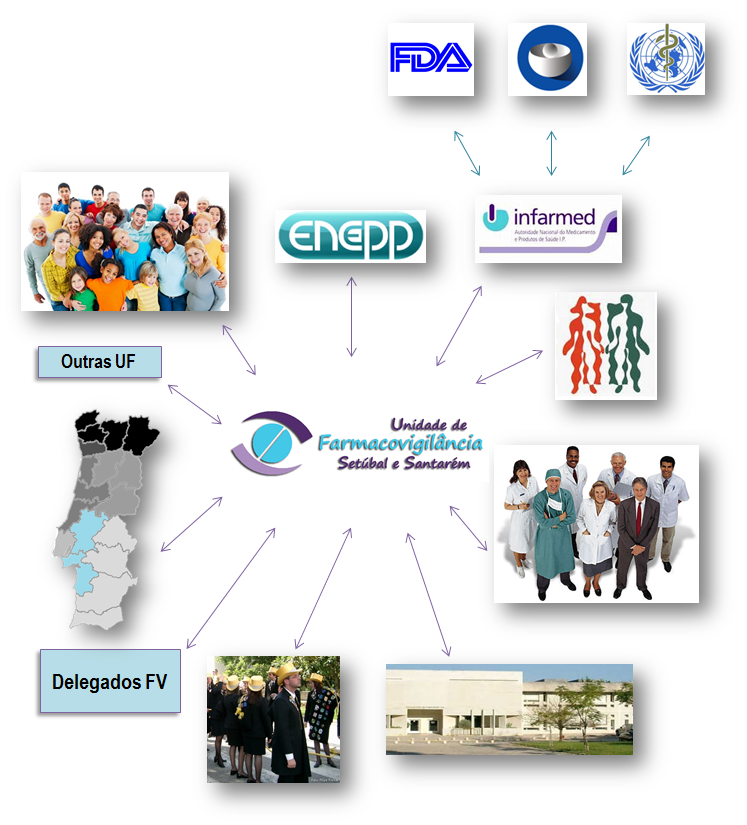
Exerce a sua atividade no âmbito da Farmacovigilância, através da receção, tratamento e avaliação das notificações de suspeitas de reações adversas a medicamentos de uso humano, ocorridas na região de Setúbal e Santarém, em estreita colaboração e sob a coordenação do Departamento de Farmacovigilância do INFARMED, I.P., a DGRM.
A região do território português sob a responsabilidade da UFS é a que diz respeito aos Distritos de Setúbal e Santarém, respetivamente com 13 e 21 Concelhos.
Missão da UFS
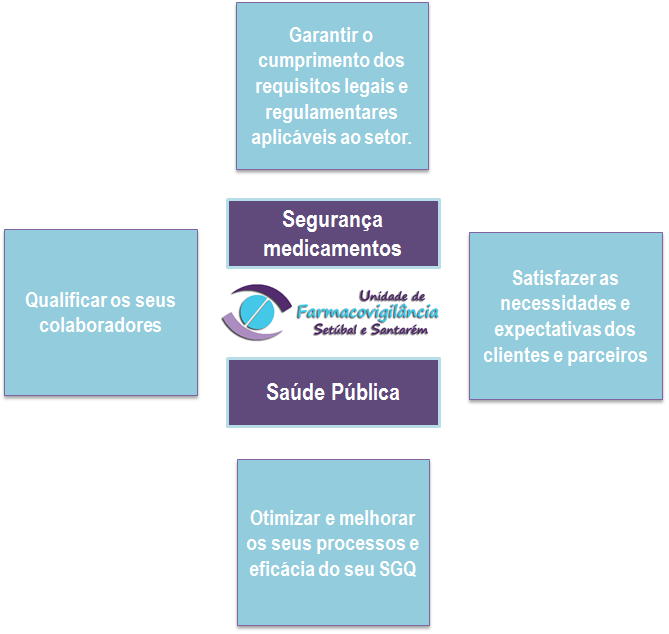
A UFS tem como missão contribuir para a proteção da Saúde Pública através da monitorização do perfil de segurança dos medicamentos de uso humano comercializados em território nacional.
A UFS, através de uma atividade pautada por profissionalismo e rigor, pretende contribuir para a geração de conhecimento sobre a segurança dos medicamentos de uso humano e, desta forma, articular-se com o INFARMED e a Agência Europeia do Medicamento (EMA) à luz da política europeia e nacional de utilização segura dos medicamentos.
Organigrama da UFS
A estrutura orgânica da UFS está representada na figura infra.
 |
A estrutura orgânica da UFS é constituida por uma equipa multidisciplinar cujos elementos interatuam de forma dinâmica no intuito de melhor satisfazer as expectativas dos seus Clientes.
Constituição da equipa UFS
Conselho Coordenador: equipa de doutorados e outros peritos, docentes da FFULisboa.
Direção Executiva: doutorado e docente da FFULisboa.
Técnicos de Farmacovigilância: mestres em Ciências Farmacêuticas.
Gestor da Qualidade: mestre em Ciências Farmacêuticas, com formação em Sistemas de Gestão da Qualidade.
Delegados de Farmacovigilância: profissionais de saúde, licenciados/mestres, distribuídos pelas instituições de Saúde das regiões de Setúbal e Santarém.
Peritos Clínicos: médicos, peritos com vasta experiência em Farmacovigilância e docentes universitários na FFUL e FMUL.
Peritos Farmacoepidemiologia: doutorados em Farmacoepidemiologia, docentes universitários da FFULisboa.
Perito Farmacoterapia/Farmacologia: doutorado em farmacoepidemiologia, docente da FFULisboa.
Perito Qualidade: licenciado, docente universitário, perito de vasta experiência em SGQ e auditorias.
Técnico de Informática: engenheiros técnicos de informática pertencentes ao departamento de informática da FFULisboa.
Estagiários: alunos e profissionais de saúde que recebem formação específica em Farmacovigilância pela UFS e colaboram com esta por períodos limitados.